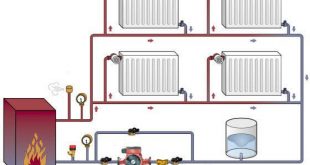
Форвакуумные насосы
Дипольный момент молекул. Для уяснения сил взаимного притяжения молекул газа необходимо обратиться к рассмотрению закономерностей взаимодействия диполей.
По современным представлениям каждый атом состоит из положительно заряженного ядра, окруженного облаком из отрицательно заряженных электронов, содержащихся в таком количестве, что при любой величине заряда ядра вся система атома является нейтральной. В нормальном состоянии центр тяжести суммарного отрицательного заряда электронов совпадает с центром тяжести положительного заряда ядра. Однако под влиянием некоторого электрического поля центры тяжестей электрических зарядов электронов и ядра в атоме могут сместиться относительно друг друга. В результате в одной части атома будут преобладать положительные заряды, а в другой — отрицательные. При этом между обоими центрами тяжести образуется определенное расстояние.

Инертные газы всегда находятся в атомарном состоянии. Атомы этих газов обладают высокой электрической симметрией, и поэтому у них отсутствует дипольный момент.
Прочные межатомные связи в молекулах образуются за счет частичного перекрывания электронных облаков. Наглядное изображение некоторых молекул представлено на рис. 1-4, где сферические поверхности являются границей электронных облаков [1-5].
В зависимости от расположения атомов в молекуле одни молекулы могут быть электрически нейтральными, а у других молекул наблюдается несовпадение центров тяжести положительных и отрицательных зарядов. Эти молекулы обладают постоянным дипольным моментом и называются полярными.

Такие насосы можно приобрести на www.blowercompressor.ru.
Когда диполи каждой из взаимодействующих пар атомов противоположны по знаку, они компенсируют друг друга и молекула не имеет полярности. Двухатомные молекулы Н2, N2, Ог и др., состоящие из одинаковых атомов в соответствии с симметричным положением связывающей их электронной пары, не обладают полярностью, и их дипольный момент равен нулю.
Когда же взаимной компенсации диполей взаимодействующих пар атомов не происходит, молекула оказывается полярной.
Двухатомные молекулы, состоящие из неодинаковых атомов, в большинстве случаев полярны. В многоатомных молекулах полярность определяется полярностью отдельных связей и их расположением в молекуле.
Так, в молекуле СОг две двойные связи углеродного атома располагаются на одной прямой и расстояния обоих атомов от углеродного равны между собой, т. е. эти молекулы обладают симметричным строением. Поэтому, хотя каждая из связей С = О обладает некоторой полярностью, вследствие полной взаимной компенсации дипольных моментов связей молекула в целом будет неполярна. Компенсация дипольных моментов связей широко распространена среди углеводородов [1-6].

При несимметричном строении молекулы полной компенсации моментов отдельных связей не происходит. Для вакуумной техники особый интерес представляют пары воды, так как они в основном определяют остаточную атмосферу в непрогреваемых системах. Молекула Н2О построена нелинейно, в ней водородные атомы расположены не симметрично относительно кислородного атома. Вследствие этого связь Н—О полярна, а молекула Н2О в целом обладает значительным дипольным моментом.
При конденсации на поверхности криопанели полярные молекулы в противоположность неполярным молекулам располагаются ориентированно, а прочность их связи оказывается во много раз большей по сравнению с прочностью связей при криоконденсации неполярных молекул.***
 Спальня: дизайн, ремонт, мебель.
Спальня: дизайн, ремонт, мебель.